
企业地址:北京海淀区西三环北路72号世纪经贸大厦B座0800室
联系电话:18500151883、010-52424396
企业邮箱:service@clinicalsoft.cn
成立时间:2010 年
企业规模:
注册资金:50万
浏览次数:3048
 获赞0
获赞0
企业地址:北京海淀区西三环北路72号世纪经贸大厦B座0800室
联系电话:18500151883、010-52424396
企业邮箱:service@clinicalsoft.cn
成立时间:2010 年
企业规模:
注册资金:50万
浏览次数:3048
临床试验是药物/医疗器械研发过程中的重要阶段、是提高医学科学技术发展水平的重要手段。如何实现临床研究的规范化管理,简化研究环节,使研究者可以较好地实施标准操作规程,提高研究质量和水平,确保试验结果的准确可靠、科学可信,从而有效缩短新药研发周期,加快药物申报注册进程,已经成为新药研发组织立足市场、战胜竞争对手的关键所在。
传统的临床研究过程,是药品/医疗器械研发组织通过分布在各研究中心的监查员,将试验相关数据和文档通过纸质文件的方式进行管理,并邮寄到数据统计部门进行数据的汇总、统计和分析。传统临床试验管理方式存在着项目管理缺乏时效性,研究过程缺乏规范性,数据和文档管理困难,文档撰写耗费人力,不利于项目总监及申办方的监管等诸多缺陷。
在出现临床试验管理系统之前,药品/医疗器械研发机构通过纸质文档或电子文档的方式对临床试验相关数据进行管理,并通过邮寄电子邮件等方式对数据进行汇总。电子文档的方式虽然较纸质文档有很多进步,但仍存在许多不足之处:
●对项目文档的管理仍存在困难;
●大部分数据仍需手工进行整理、统计和分析;
●对研究过程的规范化停留在SOP阶段;
●缺乏对项目状态的直观显示。
ClincalCloud下的临床试验管理系统(CTMS)实现临床试验数据的高效规范化管理,保证试验数据的准确性,可靠性和完整性,并为企业临床试验项目的策划、管理与实施领域的持续、稳定、全面发展提供强大的技术支持。通过运用先进的互联网技术,为CRO分布于全国各地的分支机构与办事处提供研究项目管理、研究计划追踪、研究内容交互服务。实现临床研究的规范化管理,简化研究环节,使研究者可以实施较好的标准操作规程,提高研究质量和水平,确保试验结果的准确可靠、科学可信,从而有效缩短新药研发周期,加快药物申报注册进程。具体体现在以下一些方面:
●实现临床试验项目的实时管理;
●提高CRO对项目的监管能力;
●确保临床试验流程的规范;
●实现试验数据的自动化统计分析;
●便于试验数据和项目文档的管理。
ClincalCloud下的临床试验管理系统(CTMS)严格符合ICH GCP规范,同时满足国内国家食品药品监督管理局(CFDA)的《药物临床试验质量管理规范(GCP)》法规要求。
| 相关规范 | 规范提出的要求 | CTMS对应功能 |
| ICH GCP CFDAGCP | 试验用药品与临床资料须足以支持拟进行的临床试验 | 将药品和资料是否完整作为CTMS启动项目的 必要条件 |
| ICH GCP CFDAGCP | 试验方案须已获得了伦理委员会的批准或支持意见 | 将伦理委员会审批结果作为CTMS启动项目的 必要条件 |
| ICH GCP CFDAGCP | 必须由合格的研究者为受试者提供医疗服务及医疗决策 | CTMS将医生的资质认证作为研究中心选择研 究者的必要条件 |
| ICH GCP CFDAGCP | 每个参与临床试验的人员应接受过相关的教育、培训或有以往工作经历 | 提供临床试验人员教育培训记录及简历的管 理功能,并将其作为试验人员的必要条件 |
| ICHGCP CFDAGCP | 在参加临床试验前应获得每个受试者的出于自愿的知情同意 | 未上传知情同意书的受试者不得进行访视等 后续操作 |
| ICH GCP CFDAGCP | 所有的临床试验信息应以某种方式记录、处置和保存 | 提供临床试验所有相关数据的管理功能 |
| ICH GCP CFDAGCP | 可以辨别受试者身份的记录应妥善保密 | 建立数据安全体系,确保试验数据的安全 |
| CFDA | 药品开始临床试验之前,需获得CFDA书面同意 | 将CFDA同意书作为项目启动的必要条件 |
| CFDA | 伦理委员会须设在临床试验机构内,由不同性别的委员组成 | 对伦理委员会的设置进行检测,确保符合 CFDA要求 |
| ICH GCP | 对机构审查委员会的工作程序,记录也做了详细的规定 | 为机构审查委员会的管理制定相关的约束条 件 |
| ICH GCP | 对监查员资格,责任,工作程序,报告等规定的较详细 | 为监查员设计资格管理功能,并建立工作顺 序控制机制 |
| CFDAGCP | 研究者在试验结束后保存资料5年;申办方在药品上市后保存资料5年 | 根据对试验数据的保存的相关规定,系统提 供数据保存时间的管理功能,禁止删除期限 内的试验数据 |
| ICHGCP | 研究者在试验结束后保存资料至少2年;申办方在药品上市后保存资料至少2年 | 根据对试验数据的保存的相关规定,系统提 供数据保存时间的管理功能,禁止删除期限 内的试验数据 |
除此之外,CTMS严格按照临床试验的实际流程设计项目管理流程,保证试验过程的数据完整和执行规范。临床试验流程如下:
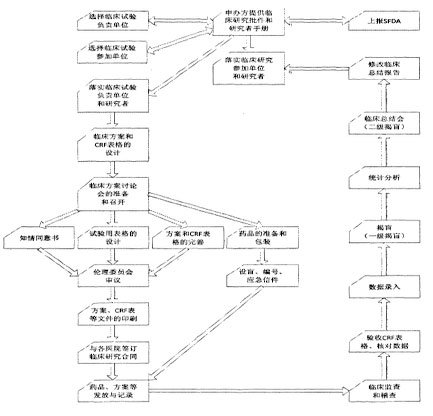
CTMS根据上述流程建立项目阶段管理机制,保证项目在完成一个阶段后才能进入下一阶段。CTMS控制临床试验各阶段的主要工作如下:
●试验开始阶段:药品临床试验前方案、人员、中心的确定,包括确定临床研究方案、申报伦理委员会、指派PL和CRA、研究中心及研究者筛选、召开研究者会议等;
●试验进行阶段:筛选受试者后对药品进行临床试验,并采集试验数据,包括研究中心启动、药品供应及回收、材料器材发放、病人筛选入组、受试者访视、提交CRF、疑问表解决、违反方案处理、SAE处理等;
●试验结束阶段:药品临床试验后研究数据的统计分析,包括药品销毁、数据锁定、数据统计分析、统计分析报告、总结会、分中心盖章、总结报告等。
Q友评论Q友评论仅代表用户个人观点,不代表Q医疗立场