
企业地址:嘉兴市南湖区汇信路28号泰格医药大楼9楼
联系电话:400-803-8655转2
企业邮箱:clinflash.service@tigermed.net
成立时间:2014 年
企业规模:15-50人
注册资金:110万
浏览次数:2783
 获赞1
获赞1
企业地址:嘉兴市南湖区汇信路28号泰格医药大楼9楼
联系电话:400-803-8655转2
企业邮箱:clinflash.service@tigermed.net
成立时间:2014 年
企业规模:15-50人
注册资金:110万
浏览次数:2783
合规、高质、高效的PV系统
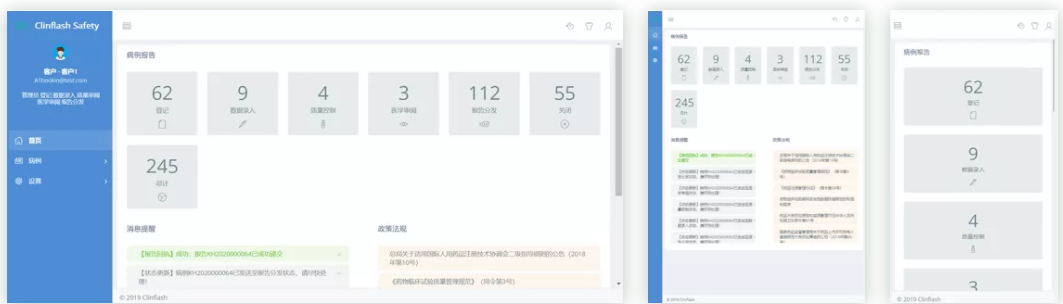
Clinflash Safety是中国领先的药物警戒信息化解决方案,支持不良事件处理、上报、分析全流程处理。该系统同时支持临床试验阶段及上市后阶段不良事件上报,可灵活应用于化药、生物制剂、疫苗、医疗器械产品的安全管理。Clinflash Safety提供了高效的个例处理方式,支持E2B R3标准,可以通过Gateway或XML方式对接各类监管机构,进行个例安全报告(ICSR)电子传输。易迪希药物警戒专家与系统开发团队共同合作,确保系统架构及流程符合国内外不断更新的药物警戒法规与标准。Clinflash Safety拥有强大的分析与报告功能,可以进一步帮助用户将药品与器械安全管理化繁为简。
合规
全操作留痕,满足核查要求
21 CFR Part 11(系统核心规范)
高质
整合高效的安全性数据管理平台
GAMP5(系统验证标准)开发
高效
简洁界面,高效操作流程
多个可自定义模块、便捷功能
主要功能
1多格式报告自动生成
2报告批量处理,报告进度管理一目了然
3质疑发送、模板调用、跟踪管理
4DSUR/PSUR相关表格信息导出
5Narrative自动撰写
6E2B自动校验,error智能提醒
7数据删除提醒,防止用户数据误删除
8数据回溯重现,可回溯任意版本录入数据
9内嵌用户手册,可针对不同用户指定专属使用指南
符合国内外法规与指南
支持国内与国际标准
1ICH标准
2E2A、E2B(R3)、E2C、E2D等
3WHO ACT药物分类编码
4WHO-Drug(DD)药品术语标准集
5WHO-ART临床术语标准集
6《药物临床试验期间安全性数据快速报告的标准和程序》
7《总局关于适用国际人用药品注册技术协调会二级指导原则的公告(2018年第10号)》
8《药品不良反应报告和监测管理办法》卫生部令第81号
9国家药品监督管理局关于药品上市许可持有人直接报告不良反应事宜的公告(2018年第66号)
10关于发布个例药品不良反应收集和报告指导原则的通告(2018年第131号)
Q友评论Q友评论仅代表用户个人观点,不代表Q医疗立场